- Avtor Jason Gerald [email protected].
- Public 2023-12-16 11:38.
- Nazadnje spremenjeno 2025-01-23 12:44.
Če se vam zdi periodična tabela zmedena in težko razumljiva, ne skrbite, niste sami! Razumevanje delovanja periodične tabele je lahko težavno, a z učenjem branja boste uspešni v znanosti. Začnite z razumevanjem strukture periodnega sistema in informacij, ki jih prikazuje o elementih. Nato lahko preučite vsak element. Na koncu uporabite podatke, navedene v periodnem sistemu, da ugotovite število nevtronov v atomu.
Korak
1. del od 3: Razumevanje strukture periodnega sistema
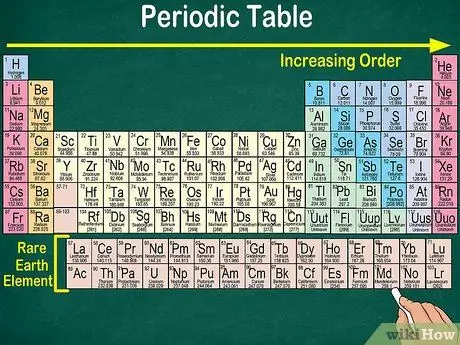
Korak 1. Preberite periodično tabelo od zgoraj levo navzdol desno
Elementi so razporejeni glede na njihovo atomsko številko. Dlje v desno in navzdol, višja je atomska številka. Atomsko število je število protonov, ki jih ima atom elementa. Ko greste bolj desno, boste opazili tudi, da se masno število vsakega atoma poveča. To pomeni, da lahko težo elementa razumete tudi samo tako, da pogledate njegovo lego na mizi.
- Bolj desno ali navzdol se bo atomska masa elementa povečala, ker se atomska masa izračuna tako, da se seštejejo protoni in nevtroni v vsakem atomu elementa. Število protonov se poveča z elementom, kar pomeni, da se poveča tudi njegova teža.
- Elektroni niso vključeni v atomsko maso, ker v primerjavi s protoni in nevtroni elektroni nimajo velikega vpliva na atomsko težo.

Korak 2. Zavedajte se, da vsak element vsebuje 1 proton več kot atom na levi strani
To lahko ugotovite tako, da pogledate atomsko številko. Atomske številke so razporejene od leve proti desni. Elementi so tudi ločeni v 3 skupine, razvrščanje si lahko ogledate v tabeli.
V prvi vrstici je na primer naveden vodik, ki ima atomsko številko 1, in helij, ki ima atomsko številko 2. Vendar sta ta dva elementa na skrajni levi in desni strani tabele, ker sta v različnih skupinah
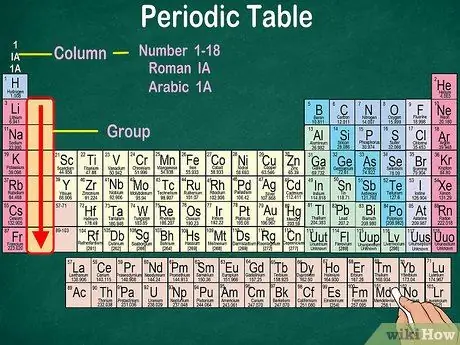
Korak 3. Opredelite skupine atomov, ki imajo enake fizikalne in kemijske lastnosti
Skupine so označene z navpičnimi stolpci. V večini primerov je za skupine značilna enaka barva. To vam pomaga ugotoviti, kateri elementi imajo podobne fizikalne in kemijske lastnosti. Tako boste lažje napovedali reakcije teh elementov. Vsak element v dani skupini ima enako število elektronov v svoji najbolj oddaljeni orbiti.
- Večina elementov pripada le eni skupini. Vendar pa lahko vodik uvrstimo med halogene ali alkalne kovine. V nekaterih tabelah se vodik pojavlja v obeh skupinah.
- V večini primerov bodo stolpci oštevilčeni od 1 do 18, bodisi na vrhu ali na dnu tabele. Številke so lahko prikazane z rimskimi številkami (IA), arabskimi številkami (1A) ali številkami (1).
- Preberite atomske skupine od zgoraj navzdol.
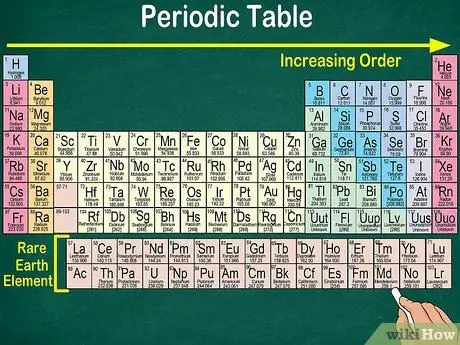
Korak 4. Opazite prazen prostor v tabeli
Razporeditev elementov v skupine in skupine poleg atomskega števila upošteva tudi enake fizikalne in kemijske lastnosti. Tako boste bolje razumeli, kako se vsak element odzove. Dodajanje kemičnih elementov otežuje njihovo razvrščanje, zato ni presenetljivo, da periodni sistem vsebuje prazen prostor.
- Na primer, prve tri vrstice imajo prazna mesta, ker so prehodne kovine, ki se pojavijo v tabeli, elementi z atomsko številko 21.
- Podobno so elementi 57 do 71, ki so redki zemeljski ali redkozemeljski elementi, upodobljeni ločeno v spodnjem desnem kotu tabele.
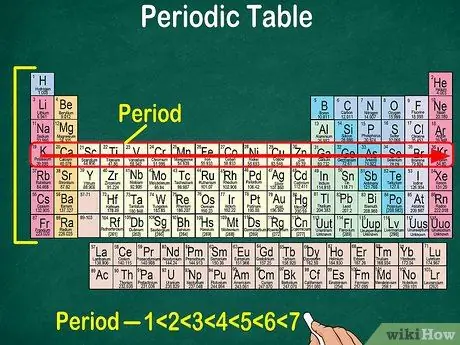
Korak 5. Upoštevajte, da se vsaka vrstica imenuje pika
Vsi elementi v obdobju imajo enako število atomskih orbitalov, skozi katere bodo prehajali elektroni. Število orbital bo ustrezalo številu obdobij. Periodni sistem prikazuje 7 vrstic, kar pomeni, da je 7 obdobij.
- Na primer, element v obdobju 1 ima 1 orbito, medtem ko ima element v obdobju 7 7 orbitalov.
- V večini primerov so pike oštevilčene od 1-7 od zgoraj navzdol na levi strani tabele.
- Preberite točko elementov, ki sledijo vrstici od leve proti desni.
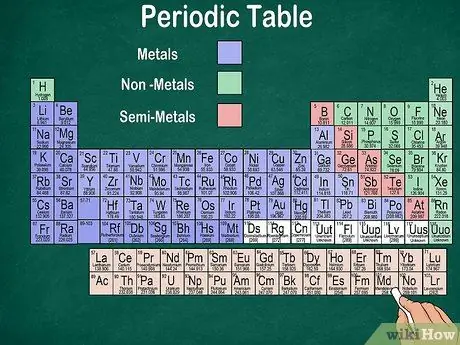
Korak 6. Razlikovati med kovinami, polkovinami in nekovinami
Lastnosti elementov lahko bolje razumete tako, da prepoznate vrsto elementa. Na srečo večina periodnega sistema uporablja barvo za označevanje, ali je element kovina, polkovina ali nekovina. Na desni strani mize boste našli kovinske elemente, na levi pa nekovinske. Skupina polkovin se nahaja med kovinami in nekovinami.
- Ne pozabite, da lahko vodik zaradi svojih lastnosti združimo s halogeni ali alkalnimi kovinami. Zato je naravno, da se vodik pojavi na obeh straneh mize ali je drugačne barve.
- Element se imenuje kovina, če je sijoč, trden pri sobni temperaturi, prevaja toploto in elektriko ter je mehak in elastičen.
- Element velja za nekovinski, če ni sijoč, ne prevaja toplote ali električne energije in je trd. Ti elementi so pri sobni temperaturi običajno plinasti, pri določenih temperaturah pa so lahko tudi trdni ali tekoči.
- Element se imenuje semimetal, če ima kombinirane lastnosti kovine in nekovine.
2. del 3: Preučevanje elementov
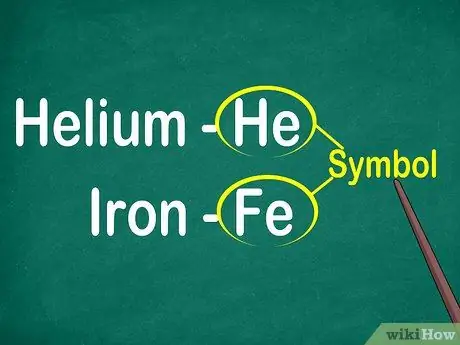
Korak 1. Prepoznajte simbole elementov od 1 do 2 črk
Simbol se običajno nahaja v središču kvadrata z veliko pisavo. Simboli so okrajšave za imena elementov, ki so standardizirana v različnih jezikih. Pri poskusih ali delu na elementarnih enačbah boste verjetno uporabili simbole elementov. Če se želite ali ne, se morate seznaniti z elementarnimi simboli.
Simboli običajno izhajajo iz latinskega imena elementa, včasih pa izvirajo iz imen, ki se pogosto uporabljajo, zlasti novih elementov. Na primer, simbol za helij je He, kar pomeni to znano ime. Vendar je simbol za železo Fe, ki ga je na prvi pogled razmeroma težko opaziti

Korak 2. Poiščite polno ime elementa, če obstaja
To je ime elementa, ki ga boste uporabili, če ga boste morali v celoti zapisati. Na primer, "helij" in "ogljik" sta imena elementov. V večini primerov je ime elementa pod simbolom, umestitev pa se lahko razlikuje.
Nekatere periodne tabele morda ne vsebujejo polnega imena in uporabljajo samo simbole
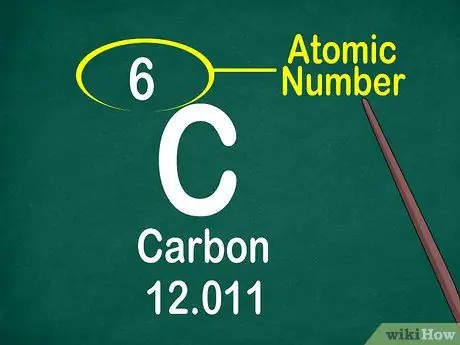
Korak 3. Zabeležite atomsko številko
Atomska številka se običajno nahaja na vrhu polja, bodisi na sredini bodisi v kotu polja. Atomska številka pa se lahko nahaja tudi pod simbolom elementa ali imenom elementa. Atomske številke so urejene od 1-118.
Atomska številka je celo število, ne decimalno
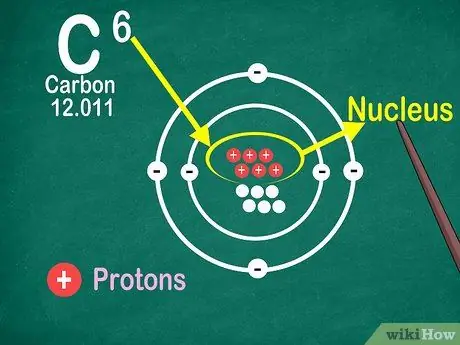
Korak 4. Vedite, da je atomsko število število protonov v atomu
Vsi atomi v elementu imajo enako število protonov. Za razliko od elektronov atomov protoni ne morejo ujeti ali sprostiti. Elementi se bodo spremenili, če lahko atomi ujamejo ali izgubijo atome.
Za določitev števila elektronov in nevtronov potrebujete tudi atomsko število
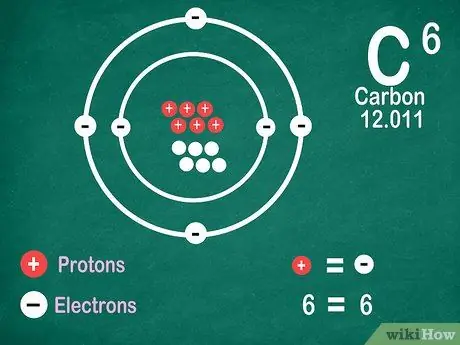
Korak 5. Vedite, da elementi vsebujejo enako število elektronov kot protoni, razen če je element podvržen ionizaciji
Protoni imajo pozitiven naboj, elektroni pa negativni naboj. Ker nevtralni atom nima električnega naboja, to pomeni, da ima enako število elektronov in protonov. Atomi pa lahko izgubijo in pridobijo elektrone, zaradi česar so ionizirani.
- Ioni so električni naboji. Če je v ionu več protonov, je naboj pozitiven, kar je znak (+) poleg simbola iona. Če je število elektronov v ionu večje, je naboj negativen, kar je negativno (-).
- Če atom ni ion, ne boste videli pozitivnega ali negativnega znaka.
3. del 3: Uporaba atomske teže za štetje nevtronov

Korak 1. Spoznajte atomsko težo
Atomska teža se običajno nahaja na dnu škatle, pod simbolom elementa. Atomska teža je skupna teža delcev v atomskem jedru, vključno s protoni in nevtroni. Vendar lahko ioni otežijo postopek štetja. Tako atomska teža označuje povprečno atomsko maso elementa in atomsko maso njegovih ionov.
- Zaradi svoje povprečne teže ima večina atomov atomsko težo v decimalni obliki.
- Čeprav se zdi, da se teža elementa poveča od leve proti desni, ni vedno tako.
Korak 2. Določite masno število elementa, ki ga preučujete
Masno število lahko najdete tako, da zaokrožite atomsko maso. To dejstvo dokazuje, da je atomska teža povprečje vseh atomskih mas, vključno z ioni.
Na primer, atomska teža ogljika je 12.011, zato je zaokrožena na 12. Podobno je atomska teža železa 55.847, zato je zaokrožena na 56
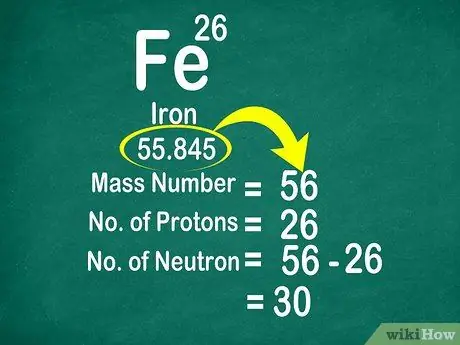
Korak 3. Odštejte masno število od atomskega števila za štetje nevtronov
Masno število je mogoče izračunati z dodajanjem števila protonov k številu nevtronov. Tako boste lažje izračunali število nevtronov v atomu, tako da odštejete masno število od števila protonov
- Uporabite to formulo: nevtron = masno število - proton
- Na primer, masno število ogljika je 12 in ima 6 protonov. Tako lahko vemo, da ima ogljik 6 nevtronov, ker je 12 - 6 = 6.
- Drug primer: masno število železa je 56 in ima 26 protonov. Tako vemo, da ima železo 30 nevtronov, ker je 56 - 26 = 30.
- Izotopi atomov vsebujejo različno število nevtronov, zato se njihova atomska teža spreminja.
Nasveti
- Branje periodnega sistema je nekaterim težko. Ne obupajte, če težko preučujete periodni sistem!
- Barve v tabeli se lahko razlikujejo, vendar vsebina ostaja enaka.
- Nekatere periodične tabele lahko vsebujejo nepopolne informacije. Na primer, nekatere tabele dajejo samo simbol in atomsko številko. V ta namen poiščite mizo, ki ustreza vašim potrebam!






